Сомнологические аспекты пребывания пациента в отделении реанимации и интенсивной терапии
Для цитирования
А.А.Белкин. Сомнологические аспекты пребывания пациента в отделении реанимации и интенсивной терапии. Consilium Medicum. 2017; 2.3: 34-37
Сон в физиологическом смысле является важнейшим элементом циркадного ритма. От него зависит вегетативная стабильность, а главное – психоэмоциональное состояние человека. На качестве сна отражаются практически любые патологические состояния, в частности, требующие пребывания в отделении реанимации и интенсивной терапии. Режим круглосуточной активности, шум оборудования, применение седатирующих препаратов – это только очевидные факторы развития так называемой реанимационной инсомнии, т.е. нарушений сна в связи с нахождением в отделении реанимации и интенсивной терапии. Чрезвычайно мало исследований посвящено данной проблеме, что понятно, так как возможности применения референтного метода полисомнографии в специфических условиях отделения реанимации и интенсивной терапии технологически затруднены. Из обзора литературы становится очевидным, что архитектура сна нарушается практически у всех пациентов реанимации, накладываясь на преморбидно существовавший или как впервые возникший синдром. Недиагностированные и развивающиеся проявления инсомнии препятствуют проведению ранней реабилитации и могут стать источником отдаленных последствий. В статье приведены выдержки из клинических рекомендаций «Реабилитация в интенсивной терапии», направленные на профилактику развития реанимационной инсомнии.
Ключевые слова: реанимационная инсомния, реабилитация в интенсивной терапии, полисомнография, мелатонин.
Для цитирования: Белкин А.А. Сомнологические аспекты пребывания пациента в отделении реанимации и интенсивной терапии. Consilium Medicum. 2017; 19 (2.3. Неврология и Ревматология): 34–37.
Review
A.A.Belkin
Ural State Medical University of the Ministry of Health of the Russian Federation. 620028, Russian Federation, Ekaterinburg, ul. Repina, d. 3;
Сlinical Institute of Brain. 623702, Russian Federation, Ekaterinburg, ul. Shilovskaia, d. 28/6
Abstract
Sleep in the physiological sense is an important element of the circadian rhythm. Depends on it vegetative stability, and most importantly – psycho-emotional state of a person. The quality of sleep reflects almost any pathological condition, in particular, requiring a stay in the intensive care unit and intensive care. The mode of round-the-clock activity, noise of equipment, application of sedating medications are only obvious factors of development of so-called resuscitation insomnia, i.e. sleep disorders due to being in the resuscitation and intensive care unit. Extremely little research is devoted to this problem, which is understandable, since the use of the reference method of polysomnography under specific conditions of the intensive care unit is technologically difficult. From the review of the literature it becomes obvious that the sleep architecture is disrupted in almost all patients of resuscitation, superimposing on a premorbidly existing or as a new syndrome. Undiagnosed and developing manifestations of insomnia prevent early recovery and can become a source of long-term consequences. The article contains excerpts from the clinical recommendations "Rehabilitation in intensive care", aimed at preventing the development of resuscitation insomnia.
Key words: reanimation insomnia, rehabilitation in intensive care, polysomnography, melatonin.
For citation: Belkin A.A. The somnological aspects of the patient's stay in the resuscitation and intensive care unit. Consilium Medicum. 2017; 19 (2.3. Neurology and Rheumatology): 34–37.
Сохранение нормального сна – одно из ключевых основных условий восстановления пациента после неотложных состояний и оперативных вмешательств. Понятие нормальности для сна имеет условное значение, более точным следует считать персональное преморбидное состояние сна пациента как цель его качественного восстановления. Реанимационная инсомния (РИ) – изменение качественных и количественных характеристик архитектуры сна у пациента, развивающееся в период пребывания в условиях отделения реанимации и интенсивной терапии (ОРИТ).
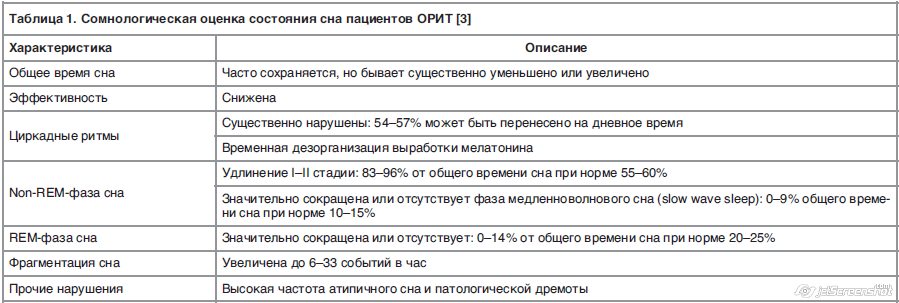
Классическое исследование сна, предполагающее использование полисомнографии, в условиях ОРИТ крайне затруднено. Тем не менее есть данные [1, 2] о состоянии основных паттернов сна пациентов ОРИТ, отражающих общую ситуацию без выделения отдельных провоцирующих диссомнию факторов (табл. 1).
Для практического применения мы классифицировали РИ, разделив причины на две группы по принципу их доступности к лечебной модификации.
 Немодифицируемые факторы:
Немодифицируемые факторы:
• повреждения и функциональные нарушения деятельности компетентных структур:
– при черепно-мозговой травме;
– остром нарушении мозгового кровообращения;
– коматозном состоянии и хронических нарушениях сознания;
• системные токсико-метаболические поражения;
• преморбидный сомнологический статус пациента.
Модифицируемые факторы:
• синдром последствий интенсивной терапии:
– ятрогенные нарушения циркадных ритмов;
– дисбаланс мелатонина;
• нарушение дыхания во сне:
– синдром обструктивного апноэ сна;
– центральные нарушения вентиляции.
Вполне понятно, что к немодицифируемым факторам следует отнести само неотложное состояние, послужившее поводом для пребывания в ОРИТ. Также очевидно, что в природе любой разновидности острой церебральной недостаточности (ОЦН) заложен механизм изменения сознания и сна. В тезисном изложении физиологию сна возможно описать как комплекс интегративных связей и баланс нейромедиаторов. Действительно, сон связан со снижением восходящих активирующих влияний ретикулярной формации на кору мозга. Сон и бодрствование регулируется взаимодействием между вентролатеральным преоптическим ядром гипоталамуса и центрами пробуждения гипоталамуса и ствола. Мелатонинпродуцирующие клетки супрахиазмального ядра гипоталамуса индуцируют сон и регулируют циркадный ритм. Серотонин и норадреналин определяют бодрствование и играют роль в формировании стадий медленного сна (non-REM sleep). Ацетилхолин обеспечивает пробуждение и играет роль в стадии REM sleep. Приведенные постулаты дают представление об уязвимости механизмов сна даже при легкой ОЦН. Если учесть, что в основе ОЦН всегда имеют место нарушение гиперполяризации мембраны нейрона при перевозбуждении NMDA-рецепторов и снижение выхода кальция из клетки, то изменения сна неизбежны, причем в первом случае сон удлиняется, а во втором, наоборот, продолжительность сна снижается. Пропорционально длительности развития ОЦН истощаются медиаторы бодрствования и сна (мелатонин, норадреналин, g-аминомасляная кислота, ацетилхолин). Непосредственное воздействие на компетентные структуры (диэнцефальная область, ствол, лимбикоретикулярный комплекс), приводящее к их функциональному (метаболическое) или морфологическому (травма, инсульт) разобщению, неизбежно деформирует структуру сна. В клиническом представлении ОЦН выступает в виде коматозного состояния. Кома, несмотря на свой сноподобный образ, сном не является, а представляет собой диффузное угнетение биоэлектрической активности мозга. Саногенетическое значение комы состоит в максимальном снижении метаболизма на период ограничения его обеспечения из-за снижения церебрального кровотока, т.е. в поддержании перфузионно-метаболического сопряжения. По истечении острейшего периода ОЦН (72 ч – 3 нед) наступает стадия восстановления циркадных ритмов, когда нарушения сна приобретают клиническое звучание. При разных формах ОЦН частота и симптомология диссомнии могут различаться. Например, при черепно-мозговой травме легкой и средней тяжести отмечены снижение продолжительности REM-стадии и увеличение non-REM, преобладает дневная сонливость, темп регресса амнезии коррелирует с восстановлением сна [4]. Регресс диссомнии имеет принципиальное значение для прогнозирования исхода для пациентов в состоянии хронического нарушения сознания. Немногочисленные, в том числе и наши собственные исследования [5], убедительно показали, что степень восстановления архитектуры сна напрямую указывает на возможность реабилитации пациента до уровня социально полноценного объекта. Преморбидный статус больного имеет значение в плане возможных нарушений в период пребывания в ОРИТ из-за отмены принимаемых снотворных, хронических диссомний, на которые «накладывается» РИ. Отмена преморбидного приема препаратов со снотворным, антидепрессивным, антипсихотическим эффектом может провоцировать rebound-эффект, особенно у бензодиазепиновых гипнотиков.
Все приведенное выше описывает проблему немодицифицируемости (предопределенности) РИ, что следует принимать во внимание при формировании программы ранней реабилитации пациентов.
Рассмотрим группу модифицируемых факторов. Наиболее актуальные проблемы составляет синдром последствий интенсивной терапии. Основные причины диссомнии связаны с особым режимом ОРИТ (постоянное освещение, шум работающих респираторов и звуки тревоги мониторов, присутствие персонала), применением анальгоседатирующих препаратов, ночным кормлением и постельным режимом. S.Bihari и соавт. [1] исследовали 100 пациентов (50 мужчин и 50 женщин) в возрасте 65,1±15,2 года с тяжестью при поступлении APACHE II – 18,1±7,5, находившихся в ОРИТ 6,7±6,5 дня. Авторами были выделены основные технологические факторы диссомнии: шум, постоянный свет, процедуры ухода, забор анализов, разговор персонала. Ведущей причиной оказался шум, создаваемый разговорами сотрудников ОРИТ по телефону. Большинство прочих шумов не приводят к пробуждению пациента, но снижают глубину сна и вызывают его фрагментацию. При мультифакторном анализе оказалось, что у всех больных сон был нарушен из-за постельного режима и спровоцированного им постоянного дремотного состояния, которое сохранялось после перевода из ОРИТ и препятствовало восстановлению обычного суточного ритма. В качестве отягощающего фактора респонденты отметили режим пребывания в ОРИТ, не учитывающий гендерных различий и необходимость достаточного личного пространства. Последнее уточнение является актуальным для отечественной интенсивной терапии, где такой нюанс никогда не принимался во внимание. Особого отношения требует медикаментозная терапия. Из фармсредств, применяемых в ОРИТ, к компрометирующим сон относят кортикостероиды и седативные препараты [4]. Кортикостероиды снижают удельный вес REM-сна, увеличивая стадию бодрствования и II стадию non-REM-сна. Группа бензодиазепинов неоднородна: наибольший негативный эффект на циркадные ритмы оказывает диазепам из-за длительного периода полувыведения и механизма последействия за счет промежуточных метаболитов. Мидазолам более физиологичен, но также нарушает архитектуру сна при непрерывной инфузии. Дискретное введение мидазолама способствует более физиологичному ночному сну [4]. В целом все бензодиазепины сокращают бодрствование, REM-сон, медленноволновой сон, увеличивая общее время сна и II стадию non-REM-сна. В меньшей степени на сон негативно влияют a2-агонисты, например дексмедетомидин [6]. В состоянии легкой седации, индуцированной инфузией этого препарата, отмечены сохранение циркадного ритма (78% сна произошло в течение ночи) и снижение фрагментации сна [4]. У пациентов, получавших дексмедетомидин на ночь, по данным ЭЭГ-мониторинга в течение 3 ночей и 2 дней (57 ч) получено достоверное удлинение II фазы сна без влияния на III (REM) стадию.
Зафиксированы также выраженное структурирование сна в ночные часы и снижение периодов дневной дремоты [7].
Нарушение метаболизма мелатонина лежит в основе технологических факторов реанимационной диссомнии. Циркадные ритмы генерируются супрахиазмальным ядром таламуса [8]. Истинный цикл возможен, только если «мастер циркадных часов» и его нервные и гуморальные пути функционируют должным образом. Гормон эпифиза мелатонин является лучшим маркером циркадной стадии в организме человека, потому что он действует в качестве эндогенного синхронизатора, способен стабилизировать и укреплять циркадные ритмы, возникающие в таламусе. Светнаведенное подавление мелатонина контролируется подмножеством неразрывно связанных светочувствительных меланопсинсодержащих ганглиозных клеток сетчатки, входящих в ретиногипоталамический тракт. Воздействие света в ночное время подавляет секрецию мелатонина. Помимо света выработку данного гормона тормозит питание в ночное время и непосредственно любое первичное церебральное повреждение в результате травмы, инсульта, нейроинфекции. Концентрация мелатонина является прогностическим фактором для определения вероятности восстановления сознания при вегетативном состоянии [5]. Важный факт состоит в том, что снижение концентрации мелатонина вне зависимости от спровоцировавшей это причины предрасполагает к развитию делирия у пациентов ОРИТ [9].
Еще одним важным аспектом реанимационной диссомнии следует считать респираторные проблемы [6]. Наиболее известный феномен обструктивного апноэ сна, распространенный у пациентов с хроническими заболеваниями легких и двусторонней пирамидной недостаточностью, возникает у пациентов на искусственной вентиляции легких (ИВЛ). Чаще всего это наблюдается при постепенном переводе пациента на спонтанные дыхания после длительной ИВЛ с применением режима pressure support, когда при неточно подобранных параметрах у больного развивается гипер- или гиповентиляция с исходом в гипокапнию или гиперкапнию соответственно. Гипокапния снижает чувствительность хеморецепторов дыхательного центра и способствует формированию центрального апноэ, а гиперкапния провоцирует компенсаторное увеличение работы дыхания [3, 10]. В результате по аналогии с истинным синдромом обструктивного апноэ сна пациент пробуждается, не достигнув глубоких стадий сна. В противном случае развивается гиповентиляция, компенсируемая увеличением работы дыхания, что также приводит к прерыванию физиологического сна. Медикаментозная седация еще глубже угнетает реактивность дыхательного центра, что усугубляет описанные ситуации.
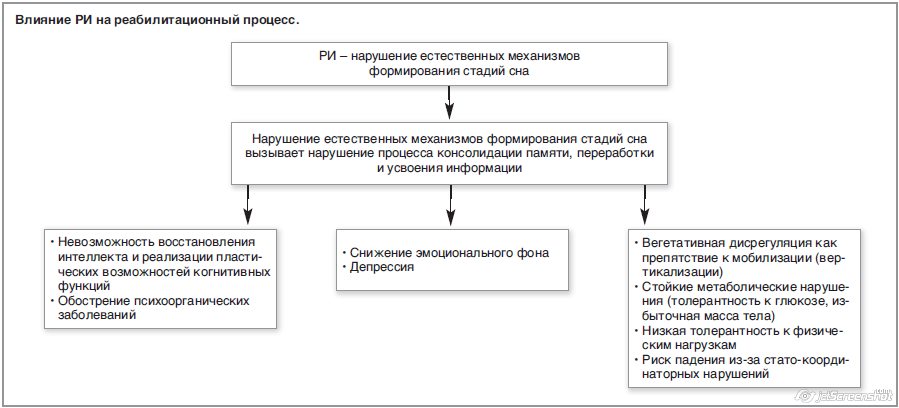
Каковы последствия РИ? Как компонент синдрома последствий интенсивной терапии РИ снижает эффективность ранней реабилитации (см. рисунок) и способствует формированию длительных психоэмоциональных нарушений, ухудшению физического статуса пациента, что в целом определяет общее снижение качества жизни [3].
В недавно принятых Федерацией анестезиологов-реаниматологов Российской Федерации и Союзом реабилитологов РФ клинических рекомендациях «Реабилитация в интенсивной терапии» [11] сформулированы принципиальные подходы к профилактике нарушений сна в период пребывания пациентов в условиях ОРИТ (табл. 2).
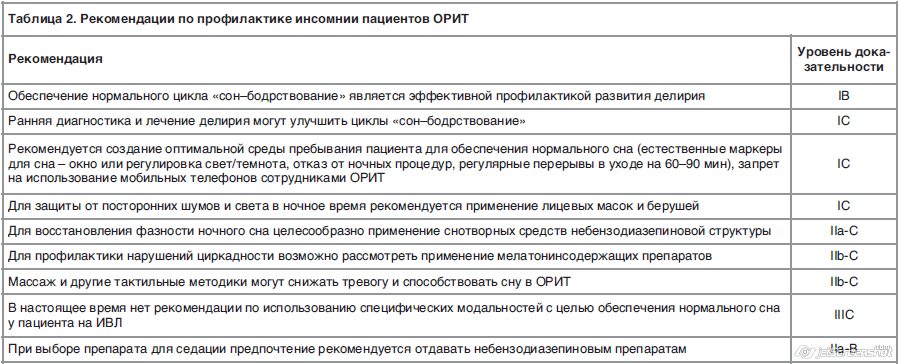
Из табл. 2 следует, что основной акцент в профилактике делается на обеспечении охранительного, в большей степени физиологического режима пребывания пациента в отделении реанимации. На практике данные рекомендации могут выглядеть как суточный распорядок гигиены сна следующим образом.
Дневные маневры:
• открытые жалюзи;
• избегание кофеинсодержащих нутриентов после 15:00;
• ограничение периода дремоты менее 50% дневного времени.
Ночные маневры:
• исключение ночного кормления;
• уменьшение яркости света в 22:00;
• опущение кроватных штор или жалюзи в 22:00;
• умывание теплой водой в 22:00;
• оптимизация комнатной температуры;
• ограничение пробуждений персоналом в интервале времени от 0:00 до 5:00;
• глазная маска и беруши.
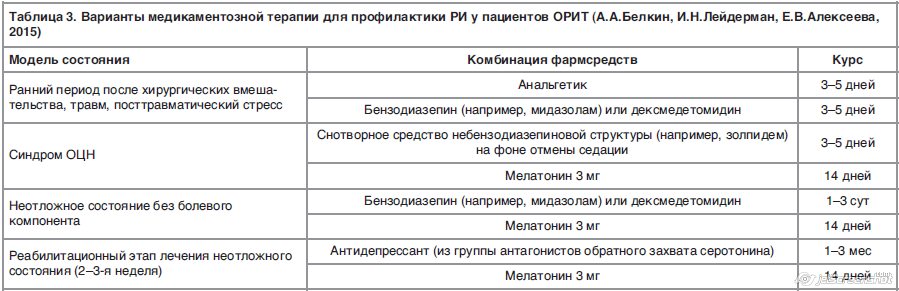
Несмотря на отсутствие статистически доказанных рекомендаций по фармакотерапии нарушений сна у пациентов ОРИТ, мы сочли возможным представить рабочий вариант возможной лекарственной комбинации, которая продемонстрировала эмпирическую эффективность (табл. 3).
Сведения об авторе
Белкин Андрей Августович – д-р мед. наук, проф. каф. анестезиологии, реаниматологии и трансфузиологии ФПК и ПП ФГБОУ ВО УГМУ, дир. АНО КИМ. E-mail: belkin@neuro-ural.ru
Ключевые слова: реанимационная инсомния, реабилитация в интенсивной терапии, полисомнография, мелатонин.
Для цитирования: Белкин А.А. Сомнологические аспекты пребывания пациента в отделении реанимации и интенсивной терапии. Consilium Medicum. 2017; 19 (2.3. Неврология и Ревматология): 34–37.
Review
The somnological aspects of the patient's stay in the resuscitation and intensive care unit
A.A.Belkin
Ural State Medical University of the Ministry of Health of the Russian Federation. 620028, Russian Federation, Ekaterinburg, ul. Repina, d. 3;
Сlinical Institute of Brain. 623702, Russian Federation, Ekaterinburg, ul. Shilovskaia, d. 28/6
Abstract
Sleep in the physiological sense is an important element of the circadian rhythm. Depends on it vegetative stability, and most importantly – psycho-emotional state of a person. The quality of sleep reflects almost any pathological condition, in particular, requiring a stay in the intensive care unit and intensive care. The mode of round-the-clock activity, noise of equipment, application of sedating medications are only obvious factors of development of so-called resuscitation insomnia, i.e. sleep disorders due to being in the resuscitation and intensive care unit. Extremely little research is devoted to this problem, which is understandable, since the use of the reference method of polysomnography under specific conditions of the intensive care unit is technologically difficult. From the review of the literature it becomes obvious that the sleep architecture is disrupted in almost all patients of resuscitation, superimposing on a premorbidly existing or as a new syndrome. Undiagnosed and developing manifestations of insomnia prevent early recovery and can become a source of long-term consequences. The article contains excerpts from the clinical recommendations "Rehabilitation in intensive care", aimed at preventing the development of resuscitation insomnia.
Key words: reanimation insomnia, rehabilitation in intensive care, polysomnography, melatonin.
For citation: Belkin A.A. The somnological aspects of the patient's stay in the resuscitation and intensive care unit. Consilium Medicum. 2017; 19 (2.3. Neurology and Rheumatology): 34–37.
Сохранение нормального сна – одно из ключевых основных условий восстановления пациента после неотложных состояний и оперативных вмешательств. Понятие нормальности для сна имеет условное значение, более точным следует считать персональное преморбидное состояние сна пациента как цель его качественного восстановления. Реанимационная инсомния (РИ) – изменение качественных и количественных характеристик архитектуры сна у пациента, развивающееся в период пребывания в условиях отделения реанимации и интенсивной терапии (ОРИТ).
Классическое исследование сна, предполагающее использование полисомнографии, в условиях ОРИТ крайне затруднено. Тем не менее есть данные [1, 2] о состоянии основных паттернов сна пациентов ОРИТ, отражающих общую ситуацию без выделения отдельных провоцирующих диссомнию факторов (табл. 1).
Для практического применения мы классифицировали РИ, разделив причины на две группы по принципу их доступности к лечебной модификации.
Классификация нарушений сна у пациентов после неотложных состояний и оперативных вмешательств (А.А.Белкин, 2016)
 Немодифицируемые факторы:
Немодифицируемые факторы:• повреждения и функциональные нарушения деятельности компетентных структур:
– при черепно-мозговой травме;
– остром нарушении мозгового кровообращения;
– коматозном состоянии и хронических нарушениях сознания;
• системные токсико-метаболические поражения;
• преморбидный сомнологический статус пациента.
Модифицируемые факторы:
• синдром последствий интенсивной терапии:
– ятрогенные нарушения циркадных ритмов;
– дисбаланс мелатонина;
• нарушение дыхания во сне:
– синдром обструктивного апноэ сна;
– центральные нарушения вентиляции.
Вполне понятно, что к немодицифируемым факторам следует отнести само неотложное состояние, послужившее поводом для пребывания в ОРИТ. Также очевидно, что в природе любой разновидности острой церебральной недостаточности (ОЦН) заложен механизм изменения сознания и сна. В тезисном изложении физиологию сна возможно описать как комплекс интегративных связей и баланс нейромедиаторов. Действительно, сон связан со снижением восходящих активирующих влияний ретикулярной формации на кору мозга. Сон и бодрствование регулируется взаимодействием между вентролатеральным преоптическим ядром гипоталамуса и центрами пробуждения гипоталамуса и ствола. Мелатонинпродуцирующие клетки супрахиазмального ядра гипоталамуса индуцируют сон и регулируют циркадный ритм. Серотонин и норадреналин определяют бодрствование и играют роль в формировании стадий медленного сна (non-REM sleep). Ацетилхолин обеспечивает пробуждение и играет роль в стадии REM sleep. Приведенные постулаты дают представление об уязвимости механизмов сна даже при легкой ОЦН. Если учесть, что в основе ОЦН всегда имеют место нарушение гиперполяризации мембраны нейрона при перевозбуждении NMDA-рецепторов и снижение выхода кальция из клетки, то изменения сна неизбежны, причем в первом случае сон удлиняется, а во втором, наоборот, продолжительность сна снижается. Пропорционально длительности развития ОЦН истощаются медиаторы бодрствования и сна (мелатонин, норадреналин, g-аминомасляная кислота, ацетилхолин). Непосредственное воздействие на компетентные структуры (диэнцефальная область, ствол, лимбикоретикулярный комплекс), приводящее к их функциональному (метаболическое) или морфологическому (травма, инсульт) разобщению, неизбежно деформирует структуру сна. В клиническом представлении ОЦН выступает в виде коматозного состояния. Кома, несмотря на свой сноподобный образ, сном не является, а представляет собой диффузное угнетение биоэлектрической активности мозга. Саногенетическое значение комы состоит в максимальном снижении метаболизма на период ограничения его обеспечения из-за снижения церебрального кровотока, т.е. в поддержании перфузионно-метаболического сопряжения. По истечении острейшего периода ОЦН (72 ч – 3 нед) наступает стадия восстановления циркадных ритмов, когда нарушения сна приобретают клиническое звучание. При разных формах ОЦН частота и симптомология диссомнии могут различаться. Например, при черепно-мозговой травме легкой и средней тяжести отмечены снижение продолжительности REM-стадии и увеличение non-REM, преобладает дневная сонливость, темп регресса амнезии коррелирует с восстановлением сна [4]. Регресс диссомнии имеет принципиальное значение для прогнозирования исхода для пациентов в состоянии хронического нарушения сознания. Немногочисленные, в том числе и наши собственные исследования [5], убедительно показали, что степень восстановления архитектуры сна напрямую указывает на возможность реабилитации пациента до уровня социально полноценного объекта. Преморбидный статус больного имеет значение в плане возможных нарушений в период пребывания в ОРИТ из-за отмены принимаемых снотворных, хронических диссомний, на которые «накладывается» РИ. Отмена преморбидного приема препаратов со снотворным, антидепрессивным, антипсихотическим эффектом может провоцировать rebound-эффект, особенно у бензодиазепиновых гипнотиков.
Все приведенное выше описывает проблему немодицифицируемости (предопределенности) РИ, что следует принимать во внимание при формировании программы ранней реабилитации пациентов.
Рассмотрим группу модифицируемых факторов. Наиболее актуальные проблемы составляет синдром последствий интенсивной терапии. Основные причины диссомнии связаны с особым режимом ОРИТ (постоянное освещение, шум работающих респираторов и звуки тревоги мониторов, присутствие персонала), применением анальгоседатирующих препаратов, ночным кормлением и постельным режимом. S.Bihari и соавт. [1] исследовали 100 пациентов (50 мужчин и 50 женщин) в возрасте 65,1±15,2 года с тяжестью при поступлении APACHE II – 18,1±7,5, находившихся в ОРИТ 6,7±6,5 дня. Авторами были выделены основные технологические факторы диссомнии: шум, постоянный свет, процедуры ухода, забор анализов, разговор персонала. Ведущей причиной оказался шум, создаваемый разговорами сотрудников ОРИТ по телефону. Большинство прочих шумов не приводят к пробуждению пациента, но снижают глубину сна и вызывают его фрагментацию. При мультифакторном анализе оказалось, что у всех больных сон был нарушен из-за постельного режима и спровоцированного им постоянного дремотного состояния, которое сохранялось после перевода из ОРИТ и препятствовало восстановлению обычного суточного ритма. В качестве отягощающего фактора респонденты отметили режим пребывания в ОРИТ, не учитывающий гендерных различий и необходимость достаточного личного пространства. Последнее уточнение является актуальным для отечественной интенсивной терапии, где такой нюанс никогда не принимался во внимание. Особого отношения требует медикаментозная терапия. Из фармсредств, применяемых в ОРИТ, к компрометирующим сон относят кортикостероиды и седативные препараты [4]. Кортикостероиды снижают удельный вес REM-сна, увеличивая стадию бодрствования и II стадию non-REM-сна. Группа бензодиазепинов неоднородна: наибольший негативный эффект на циркадные ритмы оказывает диазепам из-за длительного периода полувыведения и механизма последействия за счет промежуточных метаболитов. Мидазолам более физиологичен, но также нарушает архитектуру сна при непрерывной инфузии. Дискретное введение мидазолама способствует более физиологичному ночному сну [4]. В целом все бензодиазепины сокращают бодрствование, REM-сон, медленноволновой сон, увеличивая общее время сна и II стадию non-REM-сна. В меньшей степени на сон негативно влияют a2-агонисты, например дексмедетомидин [6]. В состоянии легкой седации, индуцированной инфузией этого препарата, отмечены сохранение циркадного ритма (78% сна произошло в течение ночи) и снижение фрагментации сна [4]. У пациентов, получавших дексмедетомидин на ночь, по данным ЭЭГ-мониторинга в течение 3 ночей и 2 дней (57 ч) получено достоверное удлинение II фазы сна без влияния на III (REM) стадию.

Зафиксированы также выраженное структурирование сна в ночные часы и снижение периодов дневной дремоты [7].
Нарушение метаболизма мелатонина лежит в основе технологических факторов реанимационной диссомнии. Циркадные ритмы генерируются супрахиазмальным ядром таламуса [8]. Истинный цикл возможен, только если «мастер циркадных часов» и его нервные и гуморальные пути функционируют должным образом. Гормон эпифиза мелатонин является лучшим маркером циркадной стадии в организме человека, потому что он действует в качестве эндогенного синхронизатора, способен стабилизировать и укреплять циркадные ритмы, возникающие в таламусе. Светнаведенное подавление мелатонина контролируется подмножеством неразрывно связанных светочувствительных меланопсинсодержащих ганглиозных клеток сетчатки, входящих в ретиногипоталамический тракт. Воздействие света в ночное время подавляет секрецию мелатонина. Помимо света выработку данного гормона тормозит питание в ночное время и непосредственно любое первичное церебральное повреждение в результате травмы, инсульта, нейроинфекции. Концентрация мелатонина является прогностическим фактором для определения вероятности восстановления сознания при вегетативном состоянии [5]. Важный факт состоит в том, что снижение концентрации мелатонина вне зависимости от спровоцировавшей это причины предрасполагает к развитию делирия у пациентов ОРИТ [9].
Еще одним важным аспектом реанимационной диссомнии следует считать респираторные проблемы [6]. Наиболее известный феномен обструктивного апноэ сна, распространенный у пациентов с хроническими заболеваниями легких и двусторонней пирамидной недостаточностью, возникает у пациентов на искусственной вентиляции легких (ИВЛ). Чаще всего это наблюдается при постепенном переводе пациента на спонтанные дыхания после длительной ИВЛ с применением режима pressure support, когда при неточно подобранных параметрах у больного развивается гипер- или гиповентиляция с исходом в гипокапнию или гиперкапнию соответственно. Гипокапния снижает чувствительность хеморецепторов дыхательного центра и способствует формированию центрального апноэ, а гиперкапния провоцирует компенсаторное увеличение работы дыхания [3, 10]. В результате по аналогии с истинным синдромом обструктивного апноэ сна пациент пробуждается, не достигнув глубоких стадий сна. В противном случае развивается гиповентиляция, компенсируемая увеличением работы дыхания, что также приводит к прерыванию физиологического сна. Медикаментозная седация еще глубже угнетает реактивность дыхательного центра, что усугубляет описанные ситуации.
Каковы последствия РИ? Как компонент синдрома последствий интенсивной терапии РИ снижает эффективность ранней реабилитации (см. рисунок) и способствует формированию длительных психоэмоциональных нарушений, ухудшению физического статуса пациента, что в целом определяет общее снижение качества жизни [3].
В недавно принятых Федерацией анестезиологов-реаниматологов Российской Федерации и Союзом реабилитологов РФ клинических рекомендациях «Реабилитация в интенсивной терапии» [11] сформулированы принципиальные подходы к профилактике нарушений сна в период пребывания пациентов в условиях ОРИТ (табл. 2).

Из табл. 2 следует, что основной акцент в профилактике делается на обеспечении охранительного, в большей степени физиологического режима пребывания пациента в отделении реанимации. На практике данные рекомендации могут выглядеть как суточный распорядок гигиены сна следующим образом.
Дневные маневры:
• открытые жалюзи;
• избегание кофеинсодержащих нутриентов после 15:00;
• ограничение периода дремоты менее 50% дневного времени.
Ночные маневры:
• исключение ночного кормления;
• уменьшение яркости света в 22:00;
• опущение кроватных штор или жалюзи в 22:00;
• умывание теплой водой в 22:00;
• оптимизация комнатной температуры;
• ограничение пробуждений персоналом в интервале времени от 0:00 до 5:00;
• глазная маска и беруши.
Несмотря на отсутствие статистически доказанных рекомендаций по фармакотерапии нарушений сна у пациентов ОРИТ, мы сочли возможным представить рабочий вариант возможной лекарственной комбинации, которая продемонстрировала эмпирическую эффективность (табл. 3).

Вывод
Достижения интенсивной терапии и реаниматологии очевидны и грандиозны. Пребывание пациента в ОРИТ – это не только шанс остаться в живых, но и неизбежная причина развития комплекса ятрогенных технологических осложнений, объединенных в синдром последствий интенсивной терапии. Инсомния в нем занимает одно из ведущих мест, поэтому ее профилактика актуальна, если считать, что помимо общепринятых целевых показателей эффективной интенсивной терапии в виде снижения летальности и сокращения длительности пребывания сегодня приобретает значение качество жизни пациента после выписки домой.Сведения об авторе
Белкин Андрей Августович – д-р мед. наук, проф. каф. анестезиологии, реаниматологии и трансфузиологии ФПК и ПП ФГБОУ ВО УГМУ, дир. АНО КИМ. E-mail: belkin@neuro-ural.ru
Список исп. литературыСкрыть список1. Bihari S, Mcevoy RD, Matheson E et al. Factors Affecting Sleep Quality of Patients in Intensive Care Unit. J Clin Sleep Med 2012; 8 (3).
2. Weber M, Webb CA, Killgore WDS. A Brief and Selective Review of Treatment Approaches for Sleep Disturbance following Traumatic Brain Injury. Sleep Dis Ther 2013; 2 (2). DOI: 10.4172/2167-0277.1000110.
3. Kamdar BB, Yang J, King LM et al. Developing, Implementing, and Evaluating a Multifaceted Quality Improvement Intervention to Promote Sleep in an ICU. Am J Med Qual 2013. DOI: 10.1177/1062860613509684.
4. Oto J, Yamamoto K, Koike S et al. Effect of daily sedative interruption on sleep stages of mechanically ventilated patients receiving midazolam by infusion. Anaesth Intensive Care 2011; 39: 392–400.
5. Белкин А.А., Алексеева Е.В., Алашеев А.М. и др. Оценка циркадности для прогноза исхода вегетативного состояния. Consilium Medicum. 2017; 19 (2): 1–4. / Belkin A.A., Alekseeva E.V., Alasheev A.M. i dr. Evaluation of circadence to predict the outcome of a vegetative state. Consilium Medicum. 2017; 19 (2): 1–4. [in Russian]
6. Cooper A, Thomley K. Sleep in critically ill patients requiring mechanical ventilation. Chest 2008; 117: 809–18.
7. Alexopoulou C, Kondili E, Diamantaki E et al. Effects of dexmedetomidine on sleep quality in critically ill patients: a pilot study. Anesthesiology 2014; 121: 801–7.
8. Guaraldi P, Sancisi E, La Morgia C et al. Nocturnal melatonin regulation in post-traumatic vegetative state: A possible role for melatonin supplementation? Chronobiol Int 2014: 1–5. DOI: 10.3109/07420528.2014.901972.
9. Cavallazzi R, Saad M, Marik PE. Delirium in the ICU: an overview. Ann Intensive Care 2012; 2 (1): 49. DOI: 10.1186/2110-5820-2-49.
10. Oto J, Yamamoto K, Koike S et al. Sleep quality of mechanically ventilated patients sedated with dexmedetomidine. Intensive Care Med 2012; 38: 1982–9. DOI: 10.1007/s00134-012-2685.
11. Белкин А.А., Давыдова Н.С., Лейдерман И.Н. и др. Клинические рекомендации. Анестезиология и реаниматология. Под ред. И.Б.Заболотских, Е.М.Шифмана. М.: ГЭОТАР-Медиа, 2016; с. 833–58. / Belkin A.A., Davydova N.S., Leiderman I.N. i dr. Klinicheskie rekomendatsii. Anesteziologiia i reanimatologiia. Pod red. I.B.Zabolotskikh, E.M.Shifmana. M.: GEOTAR-Media, 2016; s. 833–58. [in Russian]
12. Rittayamai N, Wilcox E, Drouot X et al. Positive and negative effects of mechanical ventilation on sleep in the ICU: a review with clinical recommendations. Intensive Care Med 2016; p. 1–11. DOI: 10.1007/s00134-015-4179-1.